问题
计算题
一定质量的某金属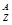 X和足量的稀H2SO4反应,生成6.02×1022个
X和足量的稀H2SO4反应,生成6.02×1022个 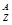 Xn+ ,这些阳离子共有6.02×1.3×1023个质子、6.02×1.4×1023个中子。
Xn+ ,这些阳离子共有6.02×1.3×1023个质子、6.02×1.4×1023个中子。
(1)求Z、n和A的值。
(2)写出该金属与稀H2SO4反应的化学方程式。
答案
(1)Z、n、A的值分别为Z = 13、n = 3、A = 27(6分)
(2)2Al+3H2SO4=Al2(SO4)3+3H2↑ (2分)
题目分析:(1)根据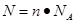 可知
可知
6.02×1022个 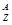 Xn+ 的物质的量是6.02×1022÷6.02×1023/mol=0.1mol
Xn+ 的物质的量是6.02×1022÷6.02×1023/mol=0.1mol
同样计算可知6.02×1.3×1023个质子、6.02×1.4×1023个中子的物质的量分别是1.3mol和1.4mol
所以Z=1.3mol÷0.1mol=13
中子数=1.4mol÷0.1mol=14
因此质量数A=13+14=27
该元素是Al,则n=3
(2)铝和稀硫酸反应的化学方程式是2Al+3H2SO4=Al2(SO4)3+3H2↑
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和规范答题能力,提高学生的应试能力和学习效率。
