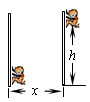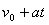(15分) (1)某兴趣小组欲准确配制一定物质的量浓度的NaOH溶液:快速准确称取8.0 g 纯净的NaOH固体,配制成100 mL溶液,该NaOH溶液的物质的量浓度为 。所需的仪器除托盘天平、钥匙、小烧杯、玻璃棒外还缺少 。
(2)有机物X由C、H、O三种元素组成的,为确定其结构进行如下实验:
a.6.0 g X在一定条件下完全分解,生成3.36 L(标准状况下)一氧化碳和1.8 g水;
b.中和2.4 g 有机物X需消耗上述NaOH溶液20.00 mL;
c.0.1 mol有机物X完全转化为酯,需要乙醇9.2 g,0.1 mol X能与足量钠反应放出3.36 L(标准状况下)氢气。则:
①X的相对分子质量为 。
②X的分子式为 。
③写出X的结构简式: 。
④写X与足量乙醇发生酯化反应的方程式 。
(1)2.0 mol/L(2分) 100ml容量瓶、胶头滴管(各1分)
(2)①120(3分)②C3H4O5(3分) ③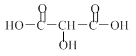 (3分)
(3分)
④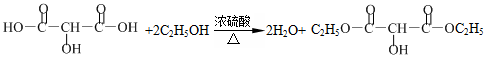 (2分)
(2分)
题目分析:(1)8g氢氧化钠的物质的量=8g÷40g/mol=0.2mol,则物质的量浓度=0.2mol÷0.1L=2.0 mol/L。需的仪器除托盘天平、钥匙、小烧杯、玻璃棒外还缺少100ml容量瓶、胶头滴管等。
(2)生成物CO的物质的量=3.36L÷22.4L/mol=0.15mol,水的物质的量=1.8g÷18g/mol=0.1mol。则根据质量守恒可知6g有机物中氧原子的物质的量是0.15mol+0.1mol=0.25mol,则该有机物中碳氢氧三种原子的个数之比0.15:0.2:0.25=3:4:5。0.1mol物质A完全转化为酯,需要乙醇9.2g÷46g/mol=0.2mol,则A分子中含有2个-COOH;完全中和2.4g物质A,需要消耗0.02L×2.0mol/L=0.04molNaOH,则2.4gA的物质的量为0.02mol,有机物A的摩尔质量为2.4g÷0.02mol=120g/mol,所以共计最简式为C3H4O5可知,该有机物的分子式即为C3H4O5。0.1molA能与足量钠反应放出3.36L(标准状况下)氢气,氢气的物质的量为0.15mol,0.1molA提供0.3molH原子,所以有机物中还含有1个-OH,有机物的分子式为C3H4O5,故有机物A的结构简式为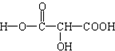 。才X与足量乙醇发生酯化反应的方程式为
。才X与足量乙醇发生酯化反应的方程式为 。
。

 水平匀速移动,经过时间t,猴子沿杆向上移动的高度为h,人顶杆沿水平地面移动的距离为x,如图所示。关于猴子的运动情况,下列说法中正确的是
水平匀速移动,经过时间t,猴子沿杆向上移动的高度为h,人顶杆沿水平地面移动的距离为x,如图所示。关于猴子的运动情况,下列说法中正确的是