问题
问答题
(1)将c1(H+)=1.00×10-2mol·L-1、c2(H+)=1.00×10-3mol·L-1的二盐酸水溶液等体积混合。计算混合液中之c(H+)。
(2)有人按下列方法进行计算:
溶液1中:
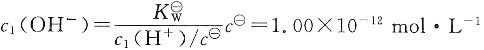
溶液2中:
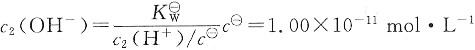
混合后溶液中OH-的物质的量为:
n(OH-)=c1(OH-)V+c2(OH-)V
所以,
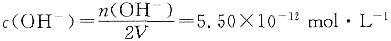
得:c(H+)=1.8×10-3mol·L-1
与你的做法相比,结果是否相同哪个不正确为什么
答案
参考答案:(1)由于二原溶液以及混合液,均为浓度不很低的强酸溶液,强酸抑制了水的离解,计算氢离子浓度时可忽略水的离解,故可认为n(H+)=c1(H+)V+c2(H+)V,得:

(2)二原溶液及混合液中之OH-,全部由水的离解得来。混合后,由于强酸浓度的变化,水的离解平衡发生移动:混合液中强酸的浓度分别比原液1、2降低、升高,使得混合液中水的离解度分别比原液1、2升高、降低。故n(OH-)≠c1(OH-)V+c2(OH-)V,题中所给方法错误。
