问题
计算题
计算题:
(Ⅰ).(6分)标准状况下,22.4LHCl气体溶于50ml水后再配成250m1溶液。
(1) 计算HCI的物质的量?
(2)计算所得盐酸的物质的量浓度?
(Ⅱ)(6分)某种待测浓度的H2SO4溶液5mL,加入10mL0.5mol/LBaCl2溶液,恰好完全反应。问得到BaSO4沉淀多少克?
答案
(1)1m0L(3分)
(2)4m0l/L。(3分)
(Ⅱ)得到BaSO4沉淀1.165克。
题目分析:标准状况下,22.4LHCl气体的物质的量: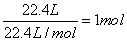
22.4LHCl气体溶于50ml水后再配成250m1溶液,所得盐酸的物质的量浓度:
(Ⅱ)解:依题意,设得到BaSO4沉淀x,则
n(BaCl2) = 0.01L×0.5mol/L =" 0.005" mol 2分
H2SO4 + BaCl2 = BaSO4↓ + 2HCl 2分
1 mol 233g
0.005 mol x
∴ x =" 1.165" g 2分
答:得到BaSO4沉淀1.165克。
点评:考查物质的量计算及其相应的推导公式计算,计算简单,重在格式的书写及计算的精确考查。
