某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL)。实验装置如下
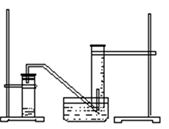
请回答:(1)进行此实验时,必须保证气密性良好,如何检验此装置的气密性?
____________________________________________________________________
(2)以下是测量收集到气体体积必须包含的几个步骤:
a.调整量筒内外液面高度使之相同;
b.使试管和量筒内的气体都冷却至室温;
c.读取量筒内气体的体积。
这三个操作步骤的正确顺序是(填写代号) _____________________。
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
_______________________________________________________
进行该操作的目的是___________________________________________
(4)如果实验中得到的氢气体积是VmL(已折算成标准状况),水蒸气的影响忽略不计
锌的摩尔质量的计算式为(含W、V,不必化简):M(Zn)= _______________________
(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导 管,表明装置不漏气 (2)b a c
(3)慢慢地将量筒下移,使量筒内气体压强等于大气压。 (4)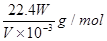
题目分析:(1)实验中,常常需要检验装置的气密性,该装置可以通过如下方法检验气密性,即将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气;(2) 测量收集到气体体积首先要使试管和量筒内的气体都冷却至室温,然后再调整量筒内外液面高度使之相同,最后读取量筒内气体的体积;(3)测量收集到气体体积时,要慢慢地将量筒下移,目的是使量筒内气体压强等于大气压,这样才能使量筒内外液面的高度相同;(4)锌与硫酸反应的化学方程式:Zn+H2SO4=ZnSO4+H2↑,实验中得到的氢气体积是VmL,即设锌的相对原子质量为M,所以M/2=W/(2×V/22.4×10-3),所以锌的摩尔质量的计算式M(Zn)=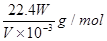 。
。
点评:本题考查了学生的基本实验基础知识,有一定的综合性,该题难度适中。
