欲测定烟雾中的SO2含量,可做下列实验:取100 L该空气(标准状况),通过盛放100 mL过氧化氢(H2O2)水溶液的吸收瓶,使烟雾中的SO2完全吸收,生成硫酸。在反应后的水溶液中加入足量BaCl2溶液,生成白色沉淀,经测定其质量为11.65g(烟雾中其他成分对测定结果无影响)。
(1)写出SO2和H2O2反应的离子方程式。
(2)写出H2SO4与BaCl2反应的离子方程式。
(3)求100 L空气中SO2的体积分数。
(1)SO2+H2O2=2H++SO42-(2分)(2)SO42-+Ba2+=BaSO4↓(2分)(3)1.12%(2分)
题目分析:(1)SO2具有还原性,双氧水具有氧化性,二者发生氧化还原反应,反应的离子方程式是SO2+H2O2=2H++SO42-。
(2)稀硫酸和氯化钡反应生成硫酸钡白色沉淀,反应的离子方程式是SO42-+Ba2+=BaSO4↓。
(3)硫酸钡的质量是11.65g,物质的量是11.65g÷233g/mol=0.05mol
因此根据S原子守恒可知,SO2的物质的量也是0.05mol
则100 L空气中SO2的体积分数是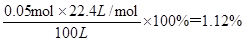 2的性质、空气中SO2含量的测定
2的性质、空气中SO2含量的测定
点评:该题是基础性试题的考查,难度不大,侧重对学生基础知识的巩固,有利于培养学生的逻辑思维能力和规范答题能力。该题的关键是利用好原子守恒,守恒法是化学计算中最常用的方法,需要在平时的学习中注意积累和总结、归纳。
