一定量的锌与100mL18.5mol•L﹣1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L.将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol•L﹣1.则生成的气体中SO2和H2的体积比为( )
A.1:2
B.2:1
C.1:4
D.4:1
答案:C
题目分析:锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为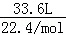 =1.5mol,剩余硫酸的物质的量为:n(H2SO4)剩=
=1.5mol,剩余硫酸的物质的量为:n(H2SO4)剩= ×1L×0.1mol/L=0.05mol,
×1L×0.1mol/L=0.05mol,
消耗硫酸的物质的量为:n(H2SO4)消耗=0.1L×18.5mol/L﹣0.05mol=1.8mol,根据反应的化学方程式计算
解:n(H2SO4)浓=0.1L×18.5mol/L=1.85mol,
剩余硫酸的物质的量为:n(H2SO4)剩= ×1L×0.1mol/L=0.05mol,
×1L×0.1mol/L=0.05mol,
消耗硫酸的物质的量为:n(H2SO4)消耗=1.85mol﹣0.05mol=1.8mol,
锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,
生成气体为SO2和H2的混合物,物质的量为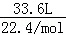 =1.5mol,
=1.5mol,
设混合物气体中含有xmolSO2,ymolH2,
Zn+2H2SO4=ZnSO4+SO2↑+H2O
2xmol xmol
Zn+H2SO4=ZnSO4+H2↑
ymol ymol
则有: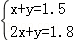
解之得: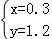
所以n(SO2):n(H2)=x:y=0.3:1.2=1:4
点评:本题考查化学方程式的计算,题目难度中等,本题注意以下几点:①浓硫酸与锌反应生成SO2,②随着反应的进行,硫酸的浓度降低,与锌反应生成H2,③根据反应的方程式利用守恒的方法列式计算
