现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图。分析该图像,并回答下列问题:

(1)写出ab段涉及的离子方程式: 。
(2)c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为 。乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
分析该表,并回答下列问题:
(3)①分析实验数据可知,实验编号为 的实验中,氢氧化钠足量,铵盐中的铵根离
子完全转化成气体;m的值为 。
②计算样品B中氮元素的质量分数。(用小数表示,保留两位小数)
(1)乙组同学在研究时发现,浓硫酸增重的质量与样品B的质量之间满足一定的函数关系。假设样品的质量为x(g),浓硫酸增重的质量为y(g)。求:当x在不同范围时y与x的函数关系。
(1)NH4+ + OH― = NH3↑+ H2O (1分)
(2)4.25 (2分) 9:2 (3分)
(3)①Ⅰ (1分) 2.04 (2分) ②17% (3分)
(4)12.35<x<49.4, y=3.4-17x/247 (4分)
题目分析:
(1)0-25ml: NaOH溶液与NH4HSO4中的H+作用:2NH4HSO4+2NaOH= (NH4)2SO4+Na2 SO4+2H2O
ab段:(NH4)2SO4+2NaOH="2" NH3↑+ 2H2O+ Na2 SO4 离子方程式:NH4+ + OH― = NH3↑+ H2O
(2)①解:设浓硫酸增重的质量为x
(NH4)2SO4+2NaOH="2" NH3↑+ 2H2O+ Na2 SO4
2 34
(275-25)/1000*1 x x="4.25" c点对应的数值是4.25
②样品A中(NH4)2SO4、NH4HSO4的物质的量之比为9/2
解:设NH4HSO4的物质的量为y
①2NH4HSO4+2NaOH= (NH4)2SO4+Na2 SO4+H2O
2 2 1
y 1*25/1000 0.025/2
y=0.025
② (NH4)2SO4+2NaOH="2" NH3↑+ 2H2O+ Na2 SO4
1 2
0.125 1*(275-25)/1000
原(NH4)2SO4:0.125-0.0125=0.1125(mol)
(NH4)2SO4、NH4HSO4的物质的量之比为0.1125/0.025=9/2
(3)I 和II可知,I铵盐最少,NaOH足量,铵盐能反应充分。浓硫酸增重的质量即氨的质量。
解:设I(第一份)NH4HSO4和(NH4)2SO4的物质的量为x和y,I中铵盐都反应了
115x+132y=9.88 放出的氨气的物质的量为x+2y
①NH4HSO4 ---------2NaOH----- NH3↑ (2)(NH4)2SO4--------2NaOH-----2 NH3↑
x x y 2y
第二份的质量是第一份的2倍,NH4HSO4的物质的量也为2倍,物质的量为2x
对于第二份:先NH4HSO4---------H+ ---------OH-
2x 2x 2x
第二份吸收氨的质量与第一份等,物质的量也等。
NH4+---------OH-
x+2y x+2y 有NaOH:2x+ x+2y=0.2*1 和115x+132y=9.88 x=0.04 y=0.04
放出的氨气的物质的量为x+2y="0.12" 放出的氨气的质量为:m=17*0.12=2.04(g)
②样品B中氮元素的质量分数:14(x+2y)*100%/9.88=17%
60、由I可知样品B中NH4HSO4和(NH4)2SO4的物质的量均为0.04 mol,是物质的量1:1混合。
假设样品的质量为x(g),浓硫酸增重的质量为y(g)。有几个特殊点
(1)0.2 molNaOH恰好反应需NH4HSO4和(NH4)2SO4的质量x(g),设NH4HSO4和(NH4)2SO4的物质的量均为n
NH4HSO4-----------2NaOH ----------- NH3↑ ;(NH4)2SO4-----------2NaOH----------- 2NH3↑
n 2n n n 2n 2n
对于NaOH :4n=0.2 n="0.05" 样品的质量 x=115*0.05+132*0.05=12.35(g)
浓硫酸增重的质量为y:即氨的质量:3n*17
(2)浓硫酸增重的质量为0时,样品的质量为x(g),此时NaOH 量不足,只与H+反应
NH4HSO4- ----------NaOH
0.2 0.2
样品B中的质量为x:0.2*115+0.2*132="49.4(g)"
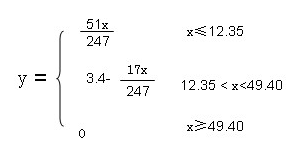
当x大于等于49.4 y=0 ;x小于等于12.35 ,NH4HSO4和(NH4)2SO4物质的量1:1混合,物质的量为x/247,含氨气3 x/247,质量为y="17*3" x/247=51x/247。12.35<x<49.4, y=3.4-17x/247
