有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
A.(y-2x)/a mol·L-1
B.(y-x)/a mol·L-1
C.(2y-2x)/a mol·L-1
D.(2y-4x)/a mol·L-1
答案:D
题目分析:设每份中的Ba2+离子的物质的量为m,Cl-离子的物质的量为n
由Ba2++SO42-=BaSO4↓
1 1
m x
解得m=x
Cl-+Ag+=AgCl↓
1 1
n y
解得n=y
设每份中的钠离子的物质的量为z,BaCl2和NaCl的混合溶液不显电性
则x×2+z=y
解得z=(y-2x)mol
则原溶液中的钠离子为(y-2x)mol×2=(2y-4x)mol
所以c(Na+)=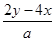 mol/L
mol/L
因此醇答案选D。

 超声提示()
超声提示()