问题
选择题
某一定量的锌与稀硫酸反应,收集到4.48L氢气(标准状况)。计算:
(1)标准状况下4.48L氢气的物质的量;
(2)参加反应的锌的质量;
(3)若所用稀硫酸的浓度为0.4 mol/L,则至少需要硫酸溶液的体积为多少升?
答案
(1)0.2mol (2)13g (3)0.5L
题目分析:解:(1)标准状况下4.48L氢气的物质的量为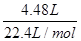 =0.2mol,
=0.2mol,
令参加反应的Zn的物质的量为xmol,则:
Zn+H2SO4=ZnSO4+H2↑
1 1
xmol 0.2mol
故x=0.2,
故参加反应的Zn的质量为0.2mol×65g/mol=13g,
答:参加反应的Zn的质量为13g;
(2)令参加反应的硫酸的物质的量为ymol,则:
Zn+H2SO4=ZnSO4+H2↑
1 1
ymol 0.2mol
故y=0.2,
至少需要硫酸溶液的体积为0.5L,

