问题
选择题
将一定的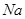 、
、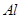 合金置于水中,结果合金完全溶解,得到20mL、PH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中
合金置于水中,结果合金完全溶解,得到20mL、PH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中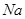 的物质的量( )
的物质的量( )
A.0.01mol
B.0.02mol
C.0.03mol
D.0.04mol
答案
答案:D
题目分析:由题意知涉及的反应为:2Na+2H2O=2NaOH+H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ HCl + NaOH="NaCl" + H2O NaAlO2+ HCl+H2O=Al(OH)3↓+NaCl,当沉淀达最大值时,溶液为NaCl溶液,根据电荷守恒得n(Na+)=n(Cl-),根据原子守恒得n(Na)=n(HCl)=0.04mol,选D。
