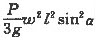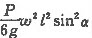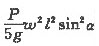化学计量在化学中占有重要地位,请回答下列问题:
(1)标准状况下6.72 L NH3分子中所含原子数与 mL H2O所含原子数相等。
(2)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 。
(3)把V L含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。(用a、b、V表示)
(1) 7.2 (2) 106 g/moL (3) 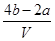 moL/L
moL/L
题目分析:(1)根据n=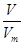 可知,在标准状况下6.72 L NH3的物质的量=6.72L÷22.4L/mol=0.3mol
可知,在标准状况下6.72 L NH3的物质的量=6.72L÷22.4L/mol=0.3mol
分子中含有原子的物质的量=0.3mol×4=1.2mol
由于水分子中含有3个原子,所以如果水分子中原子的物质的量是1.2mol
则水的物质的量=1.2mol÷3=0.4mol
其质量=0.4mol×18g/mol=7.2g
所以水的体积是7.2ml
(2)16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D
则根据质量守恒定律可知,生成C的质量=16g+20g-31.76g=4.24g
所以C的摩尔质量=4.24g÷0.04mol=106g/mol
(3)一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2,则根据方程式可知
Mg2++2OH-=Mg(OH)2↓
1mol 2mol
0.5amol amol
另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4,则根据方程式可知
Ba2++SO42-=BaSO4↓
1mol 1mol
bmol bmol
因此原溶液中Mg2+和SO42-的物质的量分别是amol和2bmol
则根据溶液的电中性可知,原混合溶液中钾离子的物质的量=4bmol-2amol
所以原混合溶液中钾离子的物质的量浓度=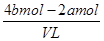 =
=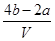 mol/L
mol/L