问题
计算题
我国是个钢铁大国,钢铁产量居世界第一位,高炉炼铁是最为普遍的炼铁方法。某种矿石中铁元素以氧化物FemOn的形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
(1)计算该铁矿石中铁元素的质量分数。
(2)计算氧化物FemOn的化学式(m、n为正整数)。
答案
(1)56% (2)Fe5O7
(1)依据8H++Mn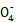 +5Fe2+
+5Fe2+ Mn2++5Fe3++4H2O可知n(Fe2+)=5n(Mn
Mn2++5Fe3++4H2O可知n(Fe2+)=5n(Mn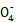 )="5×0." 025 L×2 mol·L-1="0.25" mol,m(Fe)="14" g,铁矿石中铁元素的质量分数=
)="5×0." 025 L×2 mol·L-1="0.25" mol,m(Fe)="14" g,铁矿石中铁元素的质量分数=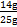 ×100%=56%;(2)参加反应n(Cu)=
×100%=56%;(2)参加反应n(Cu)= ="0.1" mol,依据2Fe3++Cu
="0.1" mol,依据2Fe3++Cu 2Fe2++Cu2+可知铁矿石中n(Fe3+)="0.2" mol、n(Fe2+)="0.25" mol-0.2 mol="0.05" mol,1个该氧化物分子含有一个+2价铁原子,含有4个+3价铁原子,依据化合价可知O原子为7个
2Fe2++Cu2+可知铁矿石中n(Fe3+)="0.2" mol、n(Fe2+)="0.25" mol-0.2 mol="0.05" mol,1个该氧化物分子含有一个+2价铁原子,含有4个+3价铁原子,依据化合价可知O原子为7个

 CH3CHBrCH2Br
CH3CHBrCH2Br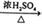 CH2=CH2 + H2O
CH2=CH2 + H2O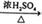 C6H5NO2+H2O
C6H5NO2+H2O