问题
选择题
把a L硫酸铵和硝酸铵的混合液分为两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与BaCl2溶液反应恰好消耗c mol BaCl2。则原溶液中NO3—的物质的量浓度是( )。
A. mol·L-1
mol·L-1
B.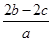 mol·L-1
mol·L-1
C.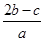 mol·L-1
mol·L-1
D. mol·L-1
mol·L-1
答案
答案:D
由NH4++OH-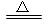 NH3↑+H2O,知一份溶液中n(NH4+)=b mol。由(NH4)SO4+BaCl2===BaSO4↓+2NH4Cl,知另一份溶液中n(SO42—)=c mol,则原混合液中,n(NH4+)=2b mol,n(SO42—)=2c mol。据电荷守恒规律可得:n(NO3—)+2n(SO42—)=n(NH4+),n(NO3—)=(2b-4c)mol,c(NO3—)=
NH3↑+H2O,知一份溶液中n(NH4+)=b mol。由(NH4)SO4+BaCl2===BaSO4↓+2NH4Cl,知另一份溶液中n(SO42—)=c mol,则原混合液中,n(NH4+)=2b mol,n(SO42—)=2c mol。据电荷守恒规律可得:n(NO3—)+2n(SO42—)=n(NH4+),n(NO3—)=(2b-4c)mol,c(NO3—)= =
=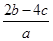 mol·L-1。
mol·L-1。
