问题
计算题
已知NaCl(s)+H2SO4(浓) NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求:
NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求:
(1)产生的HCl在标况时的体积为多少?
(2)将所得HCl气体溶于水中,配成500mL盐酸溶液,则盐酸的物质的量浓度为多少?
答案
(1)44.8L (2)4 mol/L
题目分析:(1)设生成HCl的物质的量为x
NaCl(s)+ H2SO4(浓) NaHSO4 + HCl↑
NaHSO4 + HCl↑
58.5g 1mol
117g x
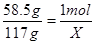 解得x="2" mol
解得x="2" mol
所以 V(HCl)=22.4L·mol-1×2mol = 44.8L
(2)C(HCl)=" n/V" =" 2mol" ÷ 0.5 L =" 4" mol/L
答:产生的HCl在标况时的体积为44.8 L,盐酸的物质的量浓度为4 mol/L.

 关系正常
关系正常