氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的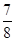 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
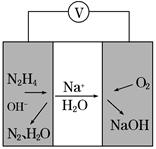
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。
③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解 可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。
(1)①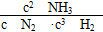 > ②c ③25% 0.05 mol/(L·min)
> ②c ③25% 0.05 mol/(L·min)
(2)①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)
ΔH=-641.5 kJ/mol
②N2H4+4OH--4e-=N2↑+4H2O
③4Cu(OH)2+N2H4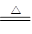 2Cu2O+N2↑+6H2O HN3
2Cu2O+N2↑+6H2O HN3
根据化学方程式可写出该反应的平衡常数表达式,该反应为放热反应,升高温度,平衡左移,平衡常数减小,故K1>K2。②当N2、H2、NH3的浓度之比为1∶3∶2时,不一定为平衡状态,a项错误;当3v(N2)正=v(H2)逆时为平衡状态,b项错误;该反应为气体体积减小的反应,当压强不变时一定达到平衡状态,c项正确;该体系中气体的质量不发生变化,容器体积不发生变化,故混合气体的密度不变,d项错误。
③设转化的N2的物质的量为x mol,则有:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始(mol) 1 3 0
转化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
根据平衡时气体的总物质的量为原来的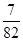 ,可得x=0.25,则N2的转化率为25%,
,可得x=0.25,则N2的转化率为25%,
v(NH3)=0.5/10=0.05 mol/(L·min)。
(2)①由题中信息可写出该反应的热化学方程式。②在原电池中,阳离子移向正极,故N2H4所在的电极为负极,发生氧化反应,其电极反应式为N2H4+4OH--4e-=N2↑+4H2O。③根据氧化还原反应原理及质量守恒定律可写出N2H4与Cu(OH)2反应的化学方程式;由于N2为0.3 mol,则氮气质量为8.4 g,又因叠氮酸的质量为8.6 g,则叠氮酸中氢元素的质量为0.2 g,从而可推知叠氮酸中H、N的原子个数比为1∶3,则其分子式为HN3。