问题
计算题
(4分)有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
答案
⑴2.3 g A中所含氢原子、碳原子的物质的量各是0.3mol、0.1mol ;
⑵该有机物的分子式为C2H6O。
题目分析:⑴解:n(O2)=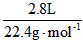 =0.125mol m(O2)=0.125 mol×32g·mol-1=4g
=0.125mol m(O2)=0.125 mol×32g·mol-1=4g
n(H2O)= = 0.15mol n(CO2) =
= 0.15mol n(CO2) =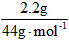 =0.05mol
=0.05mol
m(CO)=4g+2.3g-2.7g-2.2g=1.4g n(CO)=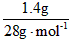 =0.05mol
=0.05mol
n(H)=2n(H2O)=0.15molx2=0.3mol;
n(C)=n(CO2)+n(CO)=0.05mol+0.05mol=0.1mol
⑵解:2.3g A中所含氧原子:
n(O)=(0.05mol×2+0.05mol+0.15mol)-0.125mol×2=0.05mol
n(C)∶n(H)∶n(O) =0.1mol∶0.3mol∶0.05mol=2∶6∶1
则A 的最简式为 C2H6O ,根据价键规则得 A的分子式为:C2H6O
