现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100 mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCl的物质的量为 mol。
(3)如果盐酸过量,生成CO2的体积为 L;
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道 。
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是 。
(1)100∶84(或25∶21)
(2) 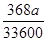 mol(或
mol(或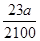 mol)
mol)
(3) 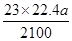 L
L
(4)盐酸的物质的量浓度(其他合理答案也可)
(5) 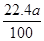 L<V(CO2)<
L<V(CO2)< 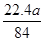 L
L
(1)质量相等时,物质的量与摩尔质量成反比,所以二者的物质的量之比是100∶84(或25∶21)。
(2)混合物中NaHCO3和KHCO3的物质的量分别为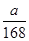 mol与
mol与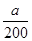 mol,则根据离子方程式HCO3-+H+===H2O+CO2↑可知,HCl的物质的量是
mol,则根据离子方程式HCO3-+H+===H2O+CO2↑可知,HCl的物质的量是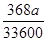 mol(或
mol(或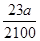 mol)。
mol)。
(3)根据碳原子守恒或反应方程式可知,生成CO2的体积是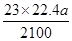 L。
L。
(4)由于盐酸不足,则生成的CO2需要以HCl的物质的量进行计算。因此还需要知道盐酸的物质的量浓度。
(5)可以采用极值法进行计算,如果全部是碳酸氢钠,则生成CO2的体积是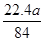 L;如果全部是碳酸氢钾,则生成的CO2的体积是
L;如果全部是碳酸氢钾,则生成的CO2的体积是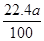 L,所以
L,所以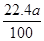 L<V(CO2)<
L<V(CO2)< 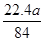 L。
L。
