问题
选择题
常温下Ca(OH)2溶于水达到饱和时存在如下平衡:Ca(OH)2(s) Ca2++2OH-,饱和石灰水的密度为d g/cm3,溶液pH=12。下列有关叙述中,不正确的是
Ca2++2OH-,饱和石灰水的密度为d g/cm3,溶液pH=12。下列有关叙述中,不正确的是
A.加热至50℃,溶液的Ca2+的浓度增大
B.该温度下Ca(OH)2的溶解度为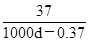 (g/100gH2O)
(g/100gH2O)
C.该饱和石灰水中,水电离出的OH-的浓度为10-12mol/L
D.加入生石灰并恢复至常温后,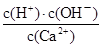 值不变
值不变
答案
答案:A
题目分析:A、氢氧化钙的溶解度随温度的升高而降低,因此加热至50℃,溶液的Ca2+的浓度减小,A不正确;B、溶液的pH=12,则溶液中氢氧根的浓度是0.01mol/L,所以氢氧化钙的浓度是0.01mol÷2=0.005mol/L。假设溶液是1L,则氢氧化钙的物质的量是0.005mol,质量是0.37g,其中溶剂水的质量是1000d-0.37g,所以氢氧化钙的溶解度是S=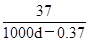 ,B正确;C、氢氧化钙是强碱抑制水的电离,则该饱和石灰水中,水电离出的OH-的浓度就是溶液中氢离子浓度为10-12mol/L,C正确;D、温度不变,离子的浓度不变,因此比值
,B正确;C、氢氧化钙是强碱抑制水的电离,则该饱和石灰水中,水电离出的OH-的浓度就是溶液中氢离子浓度为10-12mol/L,C正确;D、温度不变,离子的浓度不变,因此比值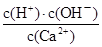 不变,D正确,答案选A。
不变,D正确,答案选A。
