问题
问答题
某校兴趣小组同学收集到含有硝酸银的溶液10g,他们利用铁锌合金回收其中的金属银,其实验过程如图所示.
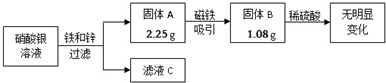
(1)固体A的成分是______(填化学式).滤液C中一定含有的溶质是______(填化学式).
(2)写出铁与硝酸银反应的化学方程式:______.
(3)计算硝酸银的相对分子质量______.原硝酸银溶液中溶质的质量为______.
答案
(1)在金属的活动性顺序里,铁比银活泼,锌比铁活泼,在此反应里,锌既和硝酸银反应,也能和铁和硝酸银反应生成的硝酸亚铁反应,溶液中一定含有Zn(NO3)2,故所得金属中不一定含锌,
故答案为:Ag和Fe,Zn(NO3)2;
(2)根据金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,金属的活动性铁>银,铁能与硝酸银反应生成硝酸亚铁和银,Fe+2AgNO3═Fe(NO3)2+2Ag,
故答案为:Fe+2AgNO3═Fe(NO3)2+2Ag;
(3)相对分子质量是化学式中各元素的相对原子质量与相应原子个数的乘积之和,AgNO3的相对分子质量为:108+14+16×3=170,根据框图,固体A为2.25克为Ag和Fe,固体B1.08克与硫酸不反应为Ag,银的物质的量为n=m M
=0.01mol,根据银原子守恒,AgNO3~Ag,所以硝酸银的物质的量为0.01mol,质量为m=n×M=0.01mol×170g/mol=1.7g;1.08g 108g/mol
故答案为:170;1.7g;
