某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程: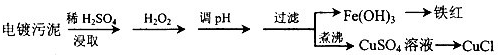
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(2)煮沸CuSO4溶液的原因是______.向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式______.
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol•L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol•L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+.通过计算说明该CuCl样品______(填“符合”或“不符合”)国家标准.
(4)25℃时,KSP[Fe(OH)3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O⇌Fe(OH)3+3H+,该反应的平衡常数为______.
(1)电镀污泥中含有铜、铁等金属化合物,酸浸后主要是溶解铜、铁等金属化合物,双氧水有强氧化性,能氧化还原性的物质,Fe2+具有还原性,酸浸后加入H2O2,Fe2+能被双氧水氧化为高价离子,便于调整pH值与
Cu2+分离,调pH步骤中加入的试剂最好是加入某种物质除去溶液中的酸且不引进新的杂质,所以要加入氧化铜、或氢氧化铜、碳酸铜,当溶液的pH值4.4时,铜离子开始出现沉淀,当溶液的pH值为3.2时,三价铁离子沉淀完全,铜离子未产生沉淀,所以要使三价铁离子和铜离子分离,过滤操作用到的仪器有铁架台、漏斗、烧杯、玻璃棒等;其中属于玻璃仪器有:漏斗、烧杯、玻璃棒,
故答案为:将Fe2+氧化成Fe3+.便于调整pH值与Cu2+分离;CuO、或Cu(OH)2、或CuCO3;漏斗、烧杯、玻璃棒;
(2)过氧化氢性质比较稳定,若加热到153℃便猛烈的分解为水和氧气,将溶液中过量的H2O2除去可加热至沸避免影响下一步CuCl的生成,因为CuSO4中+2价的铜能把Na2SO3中+4价的硫氧化成+6价的硫,向CuSO4溶液中加入一定量的NaCl、Na2SO3时生成白色的CuCl沉淀,反应的化学方程式为:2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4,
故答案为:除净溶液中的H2O2,避免影响下一步CuCl的生成;2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4;
(3)设样品中CuCl的质量为x,有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+,则:
由化学反应方程式可知:CuCl~~~Fe2+~~~Ce4+
11
n(CuCl)24.60×10-3L×0.1000mol/L
所以n(CuCl)=24.60×10-3L×0.1000mol/L=2.46×10-3mol.
所以该样品CuCl的质量为2.46×10-3mol×99.5g/mol=0.2448g.
0.2500g合格的CuCl中含有CuCl的质量0.2500g×96.5%=0.2413g,小于0.2448g,所以该样品中CuCl的质量分数符合标准,
故答案为:符合;
(4)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,c(H+)=
,反应10-14 c(OH-)
Fe3++3H2O⇌Fe(OH)3+3H+的平衡常数K=
═c3(H+) c(Fe3+)
=2.5×10-5,10-42 c(Fe3+)•c3(OH-)
故答案为:2.5×10-5.
