某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如图操作,得到了铁红、Al2O3和金属Cu,回答下列问题: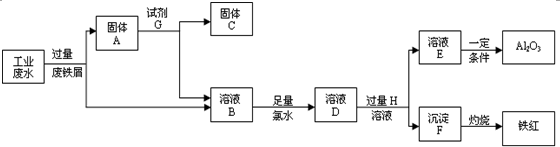
(1)固体A的成分是______.(用化学式表示)
(2)写出B→D的离子方程式______;该反应中氧化剂是______;2molCl2参加反应转移电子是______mol.溶液D中滴加KSCN溶液的现象是______.
(3)溶液E焰色反应呈黄色,试剂H是______(用化学式表示);D→E反应的离子方程式是______.
(4)分别写出铁红和氧化铝在工业上的一种主要用途:铁红______;氧化铝______.
(1)根据流程图中可以知道,完成回收铁红、Al2O3和金属Cu,先加过量铁粉,2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,Cu2++Fe=Fe2++Cu,过滤得到Fe、Cu,
故答案为:Fe、Cu;
(2)过滤所得溶液B中含有Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,2Fe2++Cl2=2Fe3++2Cl-;该反应中氯气中氯元素从0价变为产物中的氯离子,化合价降低是氧化剂;1mol氯气参加反应得到2mol电子,则2mol氯气参加反应得到4mol电子;溶液D中含有Fe3+,加KSCN溶液Fe3++3SCN-⇌Fe(SCN)3溶液变红色,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;Cl2;4;溶液变红色;
(3)分离Al3+、Fe2+,需加强碱,氢氧化铝既可以和强酸反应还可以和强碱反应,是两性氢氧化物,溶液E焰色反应呈黄色说明含有钠离子,说明试剂H是氢氧化钠;加碱先发生反应Al3++3OH-=Al(OH)3↓,强碱过量Al(OH)3+OH-=AlO2-+2H2O,总反应为:Al3++4OH-=AlO2-+2H2O,
故答案为:NaOH;Al3++4OH-=AlO2-+2H2O;
(4)铁红为氧化铁,红棕色粉末,可用于油漆、油墨、橡胶等工业中,也可做催化剂;氧化铝,可通过电解得到铝单质,所以可作制铝原料,氧化铝熔点高,可用作耐火材料,也可作工业催化剂等,
故答案为:红色油漆或涂料等;耐火材料;
