问题
探究题
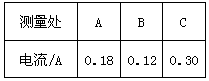
周逸凡同学进行探究实验的电路如图甲所示:
请回答以下问题:
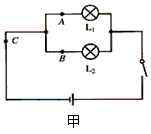
(1)L1、L2是__________联;他把电流表接入A点,当闭合开关时,发现电流表指针如图乙所示,出现这种情况的原因是:_____________________________。
(2)小明将电路检查后把电路重新连接后用电流表分别在 A、B、C三处测得电流如表所示。比较下表数据,可以得出结论是:_______________________________。
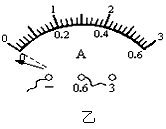
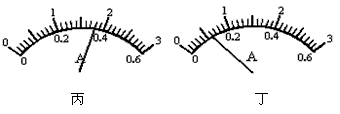
(3)小明更换电源后,将两个电流表接入如图甲所示的A、C两个位置测量,电流表的读数分别如图丙、丁示,可以判断丙示数的电流表所选的量程是__________,丁示数的电流表所选的量程是_________;通过L1的电流是_________A,可以求得通过L2的电流是___________A。
答案
(1)并; 电流表“+”、“-”接线柱接反 ;
(2)并联电路中干路电流等于各个支路电流之和
(3)0~0.6A;0~3A;0.36;0.24
