由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.
若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁:
①a电极材料为______,其电极反应式为______.
②电解液d可以是______(填编号)
A.纯水 B.NaCl 溶液 C.NaOH溶液 D.CuCl2溶液
③液体c为苯,其作用是______;在加入苯之前,对d溶液进行加热处理的目的是______.
④为了在短时间内看到白色沉淀,可以采取的措施是______.
A.改用稀硫酸做电解液 B.适当增大电源电压
C.适当缩小两电极间距离 D.适当降低电解液温度.
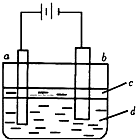
①制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,发生的电极反应为Fe-2e-=Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
②纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2,
则电解液b可选择BC,故答案为:BC;
③苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对d溶液进行加热处理的目的是排出溶液中的氧气,
故答案为:隔绝空气防止氢氧化亚铁被氧化;排尽溶液中的氧气,防止生成的氢氧化亚铁在溶液中被氧化;
④短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,而改用稀硫酸不能生成沉淀,降低温度反应速率减慢,故答案为:BC.
