金属冶炼和处理常涉及氧化还原反应.
(1)由下列物质冶炼相应金属时采用电解法的是______
a.Fe2O3 b.NaClc.Cu2Sd.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是______,当1molO2发生反应时,还原剂所失电子的物质的量为______mol.向CuSO4溶液中加入镁条时有气体生成,该气体是______
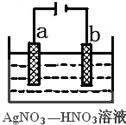
(3)右图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为______.
(1)活泼金属采用电解法冶炼,钠、铝都是活泼金属,采用电解熔融态NaCl、Al2O3的方法冶炼,故选bd;
(2)在该反应中,Cu元素化合价由+1升高到+2,S元素由-2升高到+6,所以Cu2S做还原剂;
氧化还原反应中得失电子数相等,所以当有1molO2参与反应时失去4mol电子,则还原剂所失电子的物质的量为4mol;
硫酸铜是强酸弱碱盐,其溶液呈酸性,镁和酸反应生成氢气,
故答案为:Cu2S;4;氢气;
(3)电解精炼时,粗银做阳极,所以粗银是a极;
b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3-+e-+2H+=NO2↑+H2O,
故答案为:a;NO3-+e-+2H+=NO2↑+H2O;
(4)该装置构成原电池,氯化钠溶液作电解质溶液,促进溶液的导电能力,故答案为:作电解质溶液,形成原电池.
