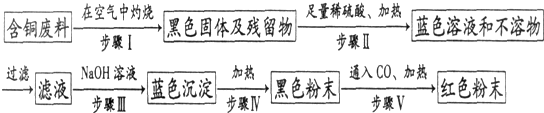
问题
问答题
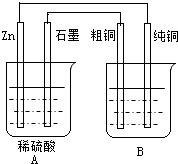
用右图装置能达到粗铜精炼的目的.
(1)A烧杯是______(填〝电解池〞或〝原电池〞),B烧杯是______(填〝电解池〞或〝原电池〞).
(2)其中B烧杯中应该盛______溶液.
(3)分别写出石墨棒和纯铜棒的电极反应式
石墨棒:______,
纯铜棒:______.
(4)若锌减少了0.65g,则纯Cu的质量增加了多少克?(写出计算过程)
答案
(1)A烧杯含有两个活泼性不同的电极,有自发的氧化还原反应,形成了闭合回路,存在电解质溶液,属于原电池装置,B烧杯就存在了外加电源,属于电解装置,故答案为:原电池;电解池;
(2)电解精炼铜时,电解质溶液必须是含有铜离子的可溶性的盐,如硫酸铜溶液或其它易溶性的铜盐等,故答案为:硫酸铜溶液或其它易溶性的铜盐;
(3)石墨棒是原电池的正极,发生电极反应为:2H++2e-=H2↑;纯铜棒是电解池的阴极,
电极反应为:Cu2++2e-=Cu,故答案为:2H++2e-=H2↑;Cu2++2e-=Cu;
(4)在A烧杯中,金属锌电极发生的电极反应为:Zn-2e-→Zn,若锌减少了0.65g即0.01mol时,转移电子为0.02mol,在B烧杯中,纯铜电极发生的反应为:Cu2++2e-→Cu,当转移0.02mol电子时,则析出金属Cu的物质的量为0.01mol,质量为0.64g,
答:纯Cu的质量增加了0.64g.