(1)甲醇是一种可再生能源,工业上一般采用下列两种反应合成甲醇:

上述反应符合“原子经济”原则的是_______________(填“Ⅰ”、“Ⅱ”或“III”)。
(2)依据甲醇燃烧的反应原理,设计如图所示的电池装置。
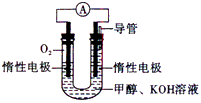
①该电池正极的电极反应为____________。
②工作一段时间后,测验得溶液的pH减小,该电池总反应的化学方式式为________________________。
(3)甲烷也是一种可再生的能源,如果用甲烷来制水煤气,反应方程式为:
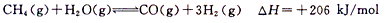
在一体积恒定为1 L的密闭器中用1mol甲烷和1mol水蒸气进行以上反应,测得甲烷的物质的量浓度随反应时间的变化如图所示。
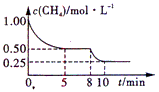
①反应在0~5min这段时间共吸收的热量为____________kJ;
②进行到5min时,反应达到平衡,这时平衡常数K的数值为____________;
③进行到8min时,只改变了影响平衡的一个条件:水蒸气的浓度。10min达到新的平衡,这时
c(H2O)=____________mol/L。(小数点后面保留一位数)
(1)I
(2)①O2+2H2O+4e-==4OH-;②2CH3OH+3O2+4OH-==2CO32-+6H2O
(3)①103;②6.75;③5.1
