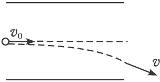
如图所示,带电粒子以平行于极板的速度从左侧中央射入匀强电场,恰好能从右侧擦极板边缘射出电场(不计粒子的重力).如果粒子的动能变为原来的两倍,要使它们仍能擦极板边缘飞出,则可以采取的措施有( )
A.将极板的长度变为原来的2倍
B.将极板的间距变为原来的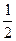
C.将两极板之间的电压变为原来的2倍
D.以上措施均不对
答案:C
该题考查了带电粒子在电场中的偏转问题,为了使推导的过程更加严密,应该借助于数学公式对粒子的运动规律进行推导,求出相关的数学表达式并据此进行分析,得出结论.
设极板的长度为l,极板之间的距离为d,两极板之间的电压为U,带电粒子的质量为m,电荷量为q,射入电场时的初速度为v0,粒子在极板之间的飞行时间为t,则粒子从极板右侧飞出时:
沿平行板方向上有:l=v0t
垂直于极板方向上:
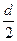 =
=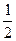
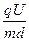 ×(
×(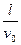 )2=
)2=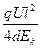 .
.