问题
填空题
(1)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应式为__________________,负极的电极反应式为__________________,原电池的总反应是__________________;当有6.5g锌溶解时,则在标准状况下,放出的氢气的体积为________,转移的电子数为__________摩尔,溶液的酸性________(填“增强”或“减弱”)。
(2)选用下列试剂和仪器设计一个原电池。画出装置图。标明原电池的正极、负极、电解质溶液,并写出正极、负极的电极反应。试剂:铜片、铁片、银片、镁条、硫酸铜溶液、硝酸银溶液。仪器:烧杯、导线、铁夹(若还需其它仪器可自己补充)
__________________________
答案
(1)正极:2H++2e-=H2↑;负极:Zn-2e-=Zn2+;总反应:Zn+2H+=Zn2++H2↑;2.24L;0.2;减弱
(2)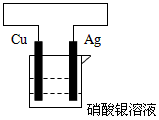
正极为Ag,负极为Cu,电解质溶液为硝酸银溶液
负极:Cu -2e-= Cu2+
正极:2Ag++2e-=2Ag
(答案合理即可)
