问题
问答题
+2价金属元素M的原子中质子数比中子数少2个,2.1g的单质M与足量的盐酸反应 * * 生氢气0.05mol.试通过计算确定:
(1)该元素的摩尔质量为______g/mol,
(2)用
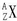
形式表示上题中金属元素M的原子______.
答案
(1)设+2价金属元素M的摩尔质量为x,
由2.1g的单质M与足量的盐酸反应 * * 生氢气0.05mol,
根据电子守恒可知,
×2=0.05mol×2×1,2.1g x
解得x=42g/mol,故答案为:42g/mol;
(2)设该原子的质子数为y,由+2价金属元素M的原子中质子数比中子数少2个,
则y+(y+2)=42,
解得y=20,为钙元素,元素符号为Ca,
原子可表示为
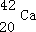
,故答案为:
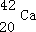
.
