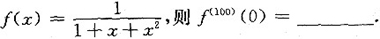问题
问答题
将5.6g铁放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算:
(1)生成标准状况下的H2多少升?
(2)所得溶液中硫酸亚铁的物质的量浓度.
答案
(1)硫酸足量,5.6g铁完全反应,令生成生成标准状况下的H2的体积为V,则:
Fe+H2SO4=FeSO4+H2
56g 22.4L
5.6g V
所以V=
×22.4L=2.24L,5.6g 56g
答:5.6g铁完全反应生成标准状况下H2的体积为2.24L;
(2)5.6g铁完全反应,根据铁元素守恒可知,溶液中n(FeSO4)=n(Fe)=
=0.1mol,溶液中c(FeSO4)=5.6g 56g/mol
=1.25mol/L,0.1mol 0.08L
答:溶液中硫酸亚铁的物质的量浓度为1.25mol/L.