已知Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为4:1.现有49.7g Cl2,将其通入到足量70℃的NaOH水溶液中,反应完全后得到500mL溶液.
(1)写出Cl2在70℃的NaOH水溶液中符合上述条件的总反应方程式
(2)计算完全反应后 生成物NaClO3的物质的量浓度.
(1)在不同的条件下,氯气和氢氧化钠的反应为:Cl2+2NaOH=NaClO+NaCl+H2O,3Cl2+6NaOH(热)=NaClO3+5NaCl+3H2O,Cl2在70℃的NaOH水溶液中反应是上述两个反应的综合过程,将两个反应相加得:4Cl2+6NaOH=NaClO+NaClO3+6NaCl+4H2O,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为4:1时,对方程式配平后得到:7Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O,故答案为:7Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O;
(2)设生成的氯酸钠的物质的量为n,则
7Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O
7 1
n49.7g 71g/mol
即
=7 49.7g 71g/mol 1 n
解得n=0.1mol
所以生成物NaClO3的物质的量浓度=
=0.2mol/L0.1mol 0.5L
答:生成物NaClO3的物质的量浓度为0.2mol/L.


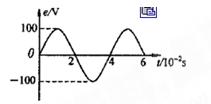
 的一半,则交流电动势的最大值和周期分别变为( )
的一半,则交流电动势的最大值和周期分别变为( )