将标准状况下4.48L的CO2通入200mL的NaOH溶液恰好充分反应后,溶液中生成盐的质量为19.0g.
(1)反应后生成的盐是(写化学式)______.
(2)200mLNaOH溶液的物质的量浓度为______.
(3)向生成的19.0g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2g Na2CO3固体.则:
①若只能加入0.05mol某物质,则加入的化合物可以是______.
②若只能加入0.10mol某物质,则加入的化合物可以是______.
(1)二氧化碳与氢氧化钠反应,若只生成碳酸钠,根据方程式结合二氧化碳的体积计算碳酸钠质量,则:
CO2+2NaOH═Na2CO3+H2O
22.4L 106g
4.48L m
所以m=21.2 g,
若只生成碳酸氢钠,根据二氧化碳的体积计算碳酸钠质量,
CO2+NaOH═NaHCO3
22.4L 84g
4.48L n
所以n=16.8 g,
由于16.8 g<19.0g<21.2 g,故19.0 g盐应为Na2CO3与NaHCO3的混合物.
故答案为:Na2CO3、NaHCO3.
(2)根据C原子守恒可知,19.0 g盐的物质的量等于二氧化碳的物质的量为
=0.2mol,所以Na2CO3与NaHCO3的平均摩尔质量为4.48L 22.4L/mol
=95g/mol,根据十字交叉法计算Na2CO3与NaHCO3的各自物质的量,19g 0.2mol
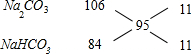
所以Na2CO3与NaHCO3的物质的量之比为11:11=1:1,所以Na2CO3为0.1 mol,NaHCO3为0.1 mol.
根据钠元素守恒可知NaOH物质的量为0.1mol×2+0.1mol=0.3mol
所以200mLNaOH溶液的物质的量浓度为
=1.5mol/L.0.3mol 0.2L
故答案为:1.5mol/L.
(3)19.0 g盐为Na2CO3为0.1 mol,NaHCO3为0.1 mol.要得到纯净的21.2g Na2CO3固体,即要将0.1 mol NaHCO3变为0.1 mol Na2CO3,
“某种物质”需满足3个条件:a.显碱性或能生成碱,b.需加入Na元素,c.不能带来其它杂质.
①中根据Na原子守恒,0.05 mol物质中需有0.1 mol Na原子,故符合条件的只有Na2O或Na2O2,
故答案为:Na2O或Na2O2;
②中根据Na原子守恒0.1 mol物质中需有0.1 mol Na,故符合条件的可有Na、NaOH等,
故答案为:Na或NaOH.
