问题
填空题
已知:反应AsO43- + 2I- + 2H+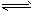 AsO33- + I2 + H2O 是可逆反应,现设计如下装置,进行操作:
AsO33- + I2 + H2O 是可逆反应,现设计如下装置,进行操作:
①操作向烧杯中逐滴滴加浓硫酸,电流表指针偏转;
②操作再取相同的另一装置,向烧杯中逐滴滴加40%NaOH溶液,电流表指针向①中指针偏向相反的方向偏转;
回答下列问题
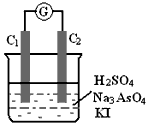
(1)从能量变化的角度分析,两次操作过程中指针发生偏转的原因是_______________
(2)用化学平衡移动原理解释,两次操作过程中指针偏转方向相反的原因是______________
(3)操作①过程中负极发生的电极反应式为__________________
操作②过程中负极发生的电极反应式为________________
答案
(1)该实验能将化学能转化为电能
(2)由于H+浓度改变,使化学平衡向不同方向移动,表现出发生不同方向的氧化还原反应
(3)负极反应:2I- - 2e- == I2;正极反应:AsO33- + H2O - 2e- == AsO43- + 2H+
