离子化合物A只由两种元素组成,两种元素的质量比为14:5,其阴阳离子电荷比为1,A不稳定,一定条件下爆炸生成B、C,以下为相关物质的转化关系,其中B、C、D、J为单质,其中只有J为固体,E为红棕色氧化物固体,反应①、②都是工业生产上的重要反应.(部分生成物略)④反应中K过量.
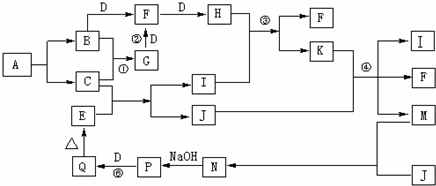
回答下列问题:
(1)A的电子式为______.
(2)K的浓溶液久置会变色,变色过程中发生反应的化学方程式为______.
(3)实验室检验含A中的阳离子的可溶性盐时的操作方法是______.
(4)反应②⑥的化学方程式为:②______,⑥______.
解(1)离子化合物A只由两种元素组成,两种元素的质量比为14:5,其阴阳离子电荷比为1,A不稳定,一定条件下爆炸生成B、C,且B、C为气体单质.根据周期表短周期主族元素的单质为气体的有H、N、O、F、Cl五种元素,能形成的常见阳离子为:NH4+,结合两种元素的质量比为14:5,其阴阳离子电荷比为1,可确定A为NH4H;电子式为:
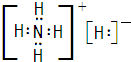
故答案为:
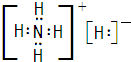
;
(2)根据氮元素的单质和化合物的性质分析B为N2、C为H2、D为O2、F为NO、H为NO2、G为NH3,反应③为NO2和水反应生成硝酸和NO,浓硝酸溶液久置会变色是因为分解生成的NO2溶解在硝酸溶液中;
反应的化学方程式为:4HNO3(浓)=2H2O+4NO2↑+O2↑;
故答案为:4HNO3(浓)=2H2O+4NO2↑+O2↑;
(3)实验室检验含A中的阳离子的可溶性盐时的操作方法是:加强碱溶液,微热,用玻棒粘湿润的红色石蕊试纸靠近试管口,观察试纸是否变蓝色;
故答案为:加强碱溶液,微热,用玻棒粘湿润的红色石蕊试纸靠近试管口,观察试纸是否变蓝色;
(4)反应②是氨气的催化氧化反应,化学方程式为:4NH3+5O2
4NO+6H2O;反应⑥是氢氧化亚铁被空气中的氧气氧化为氢氧化铁的反应,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3; 催化剂 .
故答案为:4NH3+5O2
4NO+6H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3; 催化剂 .
