过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH)。其化学方程式为
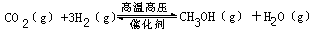
请填空:
(1)写出上述反应的平衡常数表达式:______________________
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如下图所示。下列说法正确的是____________
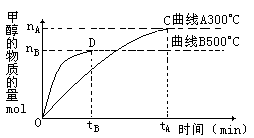
A.在300℃ ,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=nA/tA mol·(L·min)-1
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,n(H2)/n(CH3OH)增大
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,此反应的热化学方程式为: _______________________________
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是____________;正极的电极反应式:__________________。
(1)c(CH3OH)·c(H2O)/c(CO2)·c3(H2)
(2)CD
(3)CH3OH(l)+3/2O2(g)==CO2(g)+2H2O(l) △H=-725.8kJ/mol
(4)甲醇、氢氧化钠、水;O2+2H2O+4e-=4OH-
