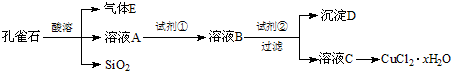
氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |
A.Cu B.Cl2 C.NH3•H2O D.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是______.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是______、______过滤和无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是______.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是______.
②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=______(用含a、b的代数式表示).
(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
A.Cu不能与Fe2+反应,故A错误;
B.Cl2可以将Fe2+氧化为Fe3+,且不引入新杂质,故B正确;
C.NH3•H2O可以沉淀Cu2+、Fe2+、Fe3+,引入铵根离子,故C错误;
D.NaOH可以沉淀Cu2+、Fe2+、Fe3+,引入钠离子,故D错误.
故选:B.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,由金属离子从开始沉淀到沉淀完全时溶液的pH可知,Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.4开始沉淀,所以应该可知pH范围为3.7~5.4.
由溶液获得CuCl2•xH2O晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.
氯化铜易溶于水,使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
故答案为:3.7~5.4;蒸发浓缩、冷却结晶;防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解CuCl2+2H2O⇌Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大.
故答案为:CuCl2•xH2O晶体加热时会发生水解.
②b g为CuO质量为
=bg 80g/mol
mol,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),所以ag=b 80
mol×(135+18x)g/mol,解得,x=b 80
.80a-135b 18b
故答案为:
.80a-135b 18b
