问题
问答题
固态化合物A由两种短周期元素组成,可与水发生复分解反应。甲组同学用如图装置(夹持装置略)对其进行探究实验。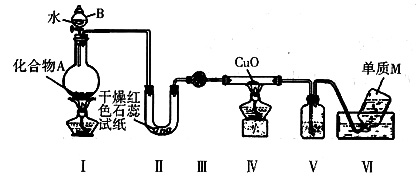
(1)仪器B的名称是______。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为______;Ⅳ中发生反应的化学方程式为______;Ⅴ中的试剂为______。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ—Ⅳ—Ⅱ—Ⅴ—Ⅵ,此时Ⅱ中现象为______,原因是______。
(4)经上述反应,2.5g化合物A理论上可得0.56L(标准状况)M;则A的化学式为______。
答案
参考答案:
(1)分液漏斗
(2)碱石灰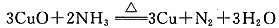 浓H2SO4
浓H2SO4
(3)试纸变蓝 CuO与氨气反应生成的水和未反应的氨气形成氨水,使试纸变蓝
(4)Mg3N2
解析:
本题涉及氨气的性质实验,探究氨气的还原性及氨水的碱性等。
仪器B的名称为分液漏斗;Ⅱ中红色石蕊试纸变蓝说明化合物A与水反应生成了氨气,氨气具有还原性,将氨气通过碱石灰干燥后,与灼热的氧化铜反应生成铜、氮气和水,用浓硫酸吸收尾气中的氨气(同时浓硫酸可防止水蒸气进入Ⅳ中),最后用排水法收集氮气。n(N2)=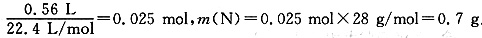 。A中
。A中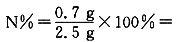 28%,结合短周期元素形成的氮化物,其中氮的百分含量为28%的只有Mg3N2,可确定A为Mg3N2。
28%,结合短周期元素形成的氮化物,其中氮的百分含量为28%的只有Mg3N2,可确定A为Mg3N2。
