问题
填空题
氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
(1)下面是氮气的一种利用途径:

过程Ⅱ的化学方程式是____ 。
(2)氨气的制备与运输过程中都有严格要求。
①合成氨时,温度过高,氨气的产率降低,试从化学平衡移动原理的角度加以解释:____ 。
②运输时,严禁与卤素(如Cl2)混装运输。二者接触时会剧烈反应产生白烟,且0.4 mol NH3参加反应时有 0.3 mol电子转移。写出反应的化学方程式:___。
③工业上可用碱性溶液通过电解的方法实现由N2制取NH3:2N2+6H2O 4NH3+3O2,通入N2的一极是___ (填“阴极”或“阳极”),阳极的电极反应式是____。
4NH3+3O2,通入N2的一极是___ (填“阴极”或“阳极”),阳极的电极反应式是____。
(3)已知:4NH3(g)+3O2(g)==2N2(g)+6H2O(g) △H=-1 316 kJ.mol-1 氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
①能利用该反应设计成电池的原因是___。
②燃料电池的负极反应式是___。
答案
(l)N2 +3H2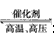 2NH3 (或 N2 +O2
2NH3 (或 N2 +O2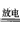 2NO)
2NO)
(2)①合成氨的反应是一个放热反应,升高温度,平衡向生成氮气和氢气的方向移动,从而使氨气的产率降低 ;
②8NH3 +3Cl2==6NH4Cl+N2 ;
③阴极;4OH--4e-==O2↑+2H2O
(3)①该反应为自发的、放热的氧化还原反应 ;②2NH3 -6e-+6OH-==N2↑+6H2O
