中国在新工业化发展过程中,开发可再生能源以缓解石油短缺引起的能源危机是一个重要的课题.2003年元月份,某省投资建设一个年生产工业酒精500万吨的工厂,目的是为了将工业酒精与汽油混合作为汽车燃料而减少汽油的消耗量.已知制酒精的方法有三种:
方法一:CH2=CH2+H2O
CH3CH2OH催化剂 △
方法二:CH3-CH2Br+H2O
CH3CH2OH+HBrNaOH △
方法三:(C6H10O5)n(淀粉)+n H2O
n C6H12O6(葡萄糖)淀粉酶
C6H12O6(葡萄糖)
2C2H5OH+2CO2↑酒化酶
(1)你认为该省生产工业酒精用的方法是哪一种?为什么?______.
(2)对于这三种制酒精的方法,下列说法正确的是______(填代号)
A、从绿色化学的角度看,方法一最好
B、从原料的可再生性来说,方法三最好
C、方法一发生了加成反应,方法二发生了取代反应
(3)分别写出①乙醇被氧化成乙醛和②汽油(C8H18)燃烧的化学方程式:①______,②______.
(4)煤经过复杂变化后得到产物之一(苯),分别写出①由苯制取硝基苯和②由苯制取环己烷的化学方程式:
①______,②______.
(1)因为淀粉是可再生资源,不符合要求,而乙烯,溴乙烷都是来自于以石油为原料制得的产品,是不可再生资源,利用它们制成酒精还不如直接利用石油,不符合要求,所以是运用了方法三,故答案为:运用了方法三,淀粉是可再生资源,而乙烯,溴乙烷都是来自于以石油为原料制得的产品,是不可再生资源,利用它们制成酒精还不如直接利用石油;
(2)A、加成反应原子利用率是100%,符合绿色化学的思想,故A正确;
B、淀粉水解生成的葡萄糖可以为人提供给能量,并且淀粉是绿色植物光合作用的产物,可循环利用,符合原料的可再生性,故B正确;
C、加成反应的特点是“有去无回”和取代反应的特点是“有去有回”,方法一发生了加成反应,方法二发生了取代反应,故C正确;
故答案为:ABC;
(3)醇被催化氧化生成醛,,乙醇催化氧化的化学方程式为:2CH3CH2OH+O2
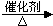
2CH3CHO+2H2O,烃类燃烧的产物是二氧化碳和水,汽油(C8H18)燃烧的化学方程式为:2C8H18+25O2→16CO2+18H2O,故答案为:2CH3CH2OH+O2
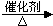
2CH3CHO+2H2O;2C8H18+25O2→16CO2+18H2O;
(4)由苯的硝化反应可以制取硝基苯,反应为

+HO-NO2 50-60℃ 浓硫酸
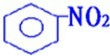
+H2O,由苯和氢气加成可以制取环己烷,反应方程式为
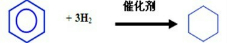
,故答案为:

+HO-NO2 50-60℃ 浓硫酸

+H2O;
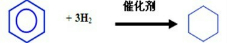
.
