如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为______.若用KMnO4氧化上述 HCl.其反应方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1mol KMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为______
(3)8mol HCl完全反应,产生的Cl2在标准状况下的体积为______.
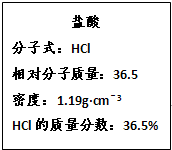
(1)该浓盐酸的物质的量浓度为
mol/L=11.9mol/L,1000×1.19×36.5% 36.5
故答案为:11.9mol/L;
(2)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2 2 2
1mol 1mol 1mol
所得产物中Cl-的物质的量n(Cl-)=n(KCl)+2n(MnCl2)=1mol+2mol=3mol,则所得产物中Cl-的物质的量浓度为
=1.5MOL/L,3mol 2L
故答案为:1.5mol/L;
(3)8mol HCl完全反应,令生成的氯气的物质的量为x,则:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
16 5
8mol x
故x=
=2.5mol,故氯气的体积为2.5mol×22.4L/mol=56L,8mol×5 16
故答案为:56L.
