[化学选修2:化学与技术]工业上为了使原料和能量得到充分的利用,常常采用循环操作.
Ⅰ、利用热化学循环制氢能缓解能源矛盾.最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢.MnFe2O4的制备:
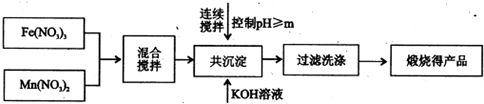
已知Fe3+、Mn2+沉淀的pH如表所示.
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
(2)控制pH的操作中m的值为______.
Ⅱ、用MnFe2O4热化学循环制取氢气:MnFe2O4(s)
MnFe2O(4-x)(s)+ 1000K .
8O2(g);△H1=akJ/mol,x 2
MnFe2O(4-x)(s)+xH2O(l)═MnFe2O4(s)+xH2(g);△H2=bkJ/mol,
(3)由上可知,H2燃烧的热化学方程式是______.
(4)该热化学循环制取氢气的优点是______(填字母编号).
A.过程简单、无污染 B.物料可循环使用 C.氧气和氢气在不同步骤生成,安全且易分离
Ⅲ、工业上可用H2、HCl通过如图的循环流程制取太阳能材料高纯硅.
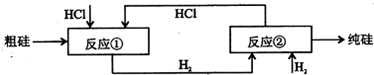
反应①Si(粗)+3HCl(g)
SiHCI3(l)+H2(g) 553--573K .
反应②:SiHCl3(l)+H2(g)
Si(纯)+3HCl(g) 1373K .
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%.则在下一轮次的生产中,需补充投入HCl和H2的体积比是______.
(1)铁酸锰的化学式为MnFe2O4,理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比2:1,故答案为:2:1
(2)Mn2+完全沉淀的PH为10.4,控制pH的操作中m的值应为10.4,故答案为:10.4;
(3)利用盖斯定律计算:
MnFe2O4(s)
MnFe2O(4-x)(s)+ 1000K .
O2(g);△H1=akJ/mol…①,x 2
MnFe2O(4-x)(s)+xH2O(1)═MnFe2O4(s)+xH2(g);△H2=bkJ/mol…②,
根据氢气燃烧的方程式H2+
O2═H2O可知热化学方程式为:H2(g)+1 2
O2(g)═H2O(l);△H=-1 2
=-①+② x
kJ/mol,a+b x
故答案为:H2(g)+
O2(g)═H2O(l);△H=-1 2
kJ/mol;a+b x
(4)制备过程无污染,生成气体为氢气和氧气,MnFe2O4可循环使用,产品易于分离,且生产安全,
故答案为:A、B、C;
(5)反应①中每消耗3molHCl生成1molH2,而反应①中HCl的利用率和反应②中H2的利用率均为75%,所以反应后剩余的HCl和H2的体积比为3:1,则在下一轮次的生产中,需补充投入HCl和H2的体积比是3:1,故答案为:3:1.
