用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.
(1)Al的原子结构示意图为______;Al与NaOH溶液反应的离子方程式为______.
(2)30Si原子的中子数为______,SiO2的晶体类型为______.
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是______.
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是______.
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,分离得到11.0g固体,滤液中加入过量NaOH溶液,分离得到21.4g固体.则此熔渣中Al2O3的质量分数为______.
(1)铝原子的原子结构示意图为
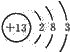
,铝和氢氧化钠、水反应生成偏铝酸钠和氢气,发生的离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:
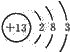
;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)中子数=质量数-质子数=30-14=16,二氧化硅晶体中含有硅原子和氧原子,原子间以共价键形成空间网状结构,属于原子晶体,故答案为:16;原子晶体;
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则Y是第VIIA元素,氢化物的沸点随着相对分子质量的增大而增大,但HF中含有氢键导致HF的沸点大于HCl,所以该族氢化物中沸点最低的是HCl,
故答案为:HCl;
(4)高温下,大理石分解生成气体CO2,所以该气体是二氧化碳,故答案为:CO2;
(5)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅;
滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据2
Fe(OH)3→Fe2O3,氧化铁的质量=160×21.4 214
g=16g,氧化铝的质量=(36.0-11.0-16)g=9g,氧化铝的质量分数=160×21.4 214
×100%=25%,9g 36g
故答案为:25%.
