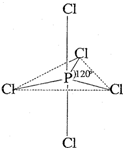
白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示.该结构中氯原子有两种不同位置.
1)6.20g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为______ L.上述燃烧产物溶于水配成50.0mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为______mol•L-1.
2)含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成l种难溶盐和16.2g H2O.该难溶盐的化学式可表示为______.
3)白磷和氯、溴反应,生成混合卤化磷PCl5-xBrx(1≤x≤4,且x为整数).如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为______.
4)磷腈化合物含有3种元素,且分子中原子总数小于20.0.10mol PCl5和0.10mol NH4Cl恰好完全反应,生成氯化氢和0.030mol磷腈化合物.推算磷腈化合物的相对分子质量(提示:M>300).
1)由白磷的相对分子质量为31×4=128,则白磷的物质的量为
=0.05mol,6.20g 128g/mol
设白磷完全燃烧生成五氧化二磷消耗氧气的物质的量为x,
则 P4+5O2
2P2O5, 点燃 .
1 5
0.05mol x
=1 0.05mol
,解得x=0.25mol,则标准状况下体积为0.25mol×22.4L/mol=5.6L,5 x
由磷原子守恒可知P4~4H3PO4,则生成磷酸的物质的量为0.05mol×4=0.20mol,
由溶液体积为50mL=0.05L,则磷酸溶液的物质的量浓度为
=4.00mol/L,0.20mol 0.05L
故答案为:5.6;4.00;
2)16.2gH2O的物质的量为
=0.09mol,0.300molH3PO4与0.500molCa(OH)2生成盐和水,16.2g 18/mol
则设盐的化学式为X,则3H3PO4+5Ca(OH)2═X+9H2O,根据质量守恒可知该物质中含有5个钙离子
和3个磷酸根离子及含有1个氢氧根离子,则盐的化学式写作Ca5(PO4)3(OH),
故答案为:Ca5(PO4)3(OH);
3)根据题意x为整数,则可能有PCl4Br、PCl3Br2、PCl2Br3、PClBr4四种,再由混合卤化磷有三种不同结构,
根据PCl5的结构可知氯原子有两种不同位置,则混合卤化磷可能为PCl3Br2或PCl2Br3,
若为PCl3Br2,则其相对分子质量可能为31+35.5×3+80×2=297.5,
若为PCl2Br3,则其相对分子质量可能为31+35.5×2+80×3=342,
故答案为:297.5或342;
4)由0.10molPCl5和0.10molNH4Cl恰好完全反应,生成氯化氢和0.030mol磷腈化合物,
根据质量守恒定律,则化合物提供的Cl原子的物质的量为0.1mol×5+0.1mol×1=0.6mol,
又磷腈化合物中只含有三种元素,则必须将其中的氢原子全部除去,两物质提供的H原子
的物质的量为0.1mol×4=0.4mol,由氢原子守恒则生成的氯化氢的物质的量为0.4mol,
则磷腈化合物中含有的Cl原子为0.6mol-0.4mol=0.2mol、P原子为0.1mol、N原子为0.1mol,
则该化合物的最简式为PNCl2;设磷腈化合物的分子式为(PNCl2)x,由其含有的碳原子总数小于20,
则知:4x<20,故x<5;
假设x=4,其分子式为P4N4Cl8,相对分子质量为31×4+14×4+35.5×8=464;
假设x=3,其分子式为P3N3Cl6,相对分子质量为31×3+14×3+35.5×6=348;
假设x=2,其分子式为P2N2Cl4,相对分子质量为31×2+14×2+35.5×4=232<300,则不符合题意应舍去,
答:磷腈化合物的相对分子质量可能为348或464.
