用KMnO4氧化密度为1.19g•cm-3.溶质质量分数为36.5%的HCl溶液.反应方程式如下:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出上述反应电子转移的方向和数目
(2)15.8gKMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(3)求生成的Cl2 在标准状况下的体积为多少?
(1)根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示:
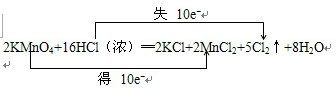
,故答案为:

(2)15.8gKMnO4的物质的量为:
=0.1mol,发生上述反应的氯化氢的物质的量为x,产生的氯气的物质的量为y,则15.8g 158g/mol
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
2 16 5
0.1mol x y
所以
=2 0.1mol
=16 x 5 y
解得:x=0.8mol,y=0.25mol
所以发生反应的HCl的质量M=nM=0.8mol×36.5g/mol=29.2g,被氧化的盐酸和参加反应盐酸的物质的量之比为:10:16=5:8,所以被氧化的HCl质量为:29.2g×
=18.25g,5 8
答:参加反应的HCl为29.2g,其中有18.25g被氧化;
(3)标准状况下可产生氯气的体积V=nVm=0.25mol×22.4L/mol=5.6L,
答:生成的Cl2 在标准状况下的体积为5.6L.