甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2 (g)  CH3OH(g) △H1
CH3OH(g) △H1
反应Ⅱ:CO2(g)+3H2 (g)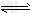 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
在以上制备甲醇的两个反应中,反应I优于反应Ⅱ,原因为____________
下表所列数据是反应I在不同温度下的化学平衡常数的数值:

①在一密闭容器中发生反应工并达到平衡后,保持其他条件不变,对容器升温,此反应的化学平衡应____(填“正向”“逆向”或“不”)移动。
②某温度下,将1 mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1 mol/L,则CO的转化率为____,此时的温度____(填“>”“<”或 “=”)250℃。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+ 4H2O(l) △H1=-Q1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-Q2 kJ/mol
③H2O(g)=H2O(l) △H3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:_____________。
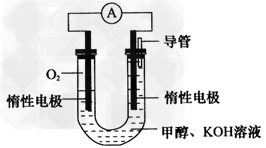
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将_____________(填“升高” “降低”或“不变”),该燃料电池负极反应的离子方程式为_____________。
(1)反应I符合,即原子利用率为100% ;①逆向 ;②80% ;<
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=(2Q3+0.5Q2 -0. 5Q1)kJ/mol
(3)降低 ;CH3OH-6e-+8OH-=CO32- +6H2O
