试回答下列问题:
(1)漂粉精在空气中长期露置时会变质,则其变质的有关化学方程式为______.
(2)把1molNa和1mol Mg分别投入到过量且等体积的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma______mb
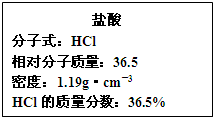
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为______mol/L.
②标准状况下,1.00L水(密度:1.00g•cm-3)吸收______L的HCl可制得上述浓盐酸.
(1)因碳酸的酸性大于次氯酸,故漂粉精中的Ca(ClO)2与二氧化碳反应发生反应:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,符合强酸制弱酸.
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(2)0.1mol的Mg为2.4g,置换出0.1mol氢气即0.2g的氢气,差量为2.4g-0.2g=2.2g,即溶液增重2.2g;0.1mol的Na为2.3g,置换出0.05mol氢气即0.1g的氢气,差量为2.3g-0.1g=2.2g,即溶液增重2.2g,而原来盐酸的质量相等,所以反应后两溶液的质量相等.
故答案为:等于
(3)①设盐酸的体积为VL,则溶质的质量为V×1000mL×1.19g•cm-3×36.5%,溶质的物质的量为
=11.9Vmol,所以溶质的物质的量浓度为V×1000mL×1.19g•cm-3×36.5% 36.5mol/L
=11.9mol/L.11.9Vmol VL
②1.00L水(密度:1.00g•cm-3)的质量为1000g,设HCl气体的体积为VL,则
W=
×100%=m(溶质) m(溶液)
×100%=36.5%,解得V=353
×36.5g/molVL 22.4L/mol
×36.5g/mol+1000gVL 22.4L/mol
故答案为:353
