有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:
H2(g)+ 1/2O2(g)=H2O(l) △H1= -285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2= -889.6 kJ/mol
H2O(l)=H2O(g) △H3= +44.0 kJ/mol
(1)第③步反应的热化学方程式为______________________ 。并找出CO2的等电子体___________(一到二种)
(2)若在第②步电解吸收液时产生11.2LO2(标准状况下),则第③步中最多可制得______ L甲烷(标准状况下)
(3)为探究在密闭容器中进行第③步反应的最佳投料比,某研究小组向恒温(T1、T2均大于100℃)恒容容器中充入一定量的H2,在其他条件不变的情况下,改变起始CO2的物质的量测定达到平衡时CH4的体积分数,实验结果如图所示。则a、c两点处所的平衡状态中,氢气的转化率的大小关系是α(a)_______α(c)(填“>”“<”或“=”),a、b、c、d四点所处的平衡状态中,对应的平衡常数Ka、Kb、Kc、Kd的大小关系是__________________。
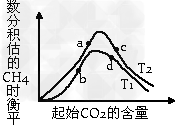
(4)H2和CO2在一定条件下也能转化成甲酸。甲酸,空气,质子交换膜和惰性电极组成的燃料电池工作时,负极反应物为_______发生的电极反应可表示为_____________。正极反应物为_________发生的电极反应可表示为______________。
(1)CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-165.6kJ/mol;CS2、N2O
(2)5.6
(3)<;Ka=Kc>Kb=Kd
(4)HCOOH;2HCOOH-4e-=2CO2↑+4H+ ;O2、H+;O2+ 4e-+ 4H+ = 2H2O
