为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
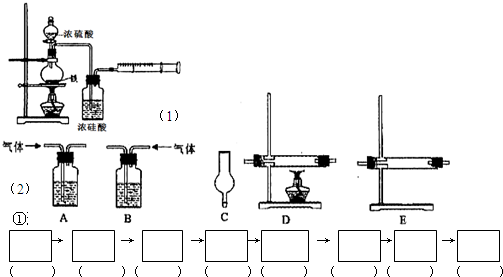
(1)实验目的:分析铁与浓硫酸在加热条件下的反应.
①洗气瓶中浓硫酸的作用是______.
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式______.
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验.
(2)实验目的:检验气体的成分.
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰.
仪器如下图(可重复使用,可根据需要取用);
①连接仪器.将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是______.
(3)实验目的:确定产物的含量.
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有______.
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe3+可采用的试剂为______;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为______mol.
(1)①浓硫酸具有吸水性,可用作干燥剂,故答案为:干燥;
②铁在加热条件下发生氧化还原反应生成硫酸铁和二氧化硫气体,反应的化学方程式为2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O, △ .
故答案为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O; △ .
(2)①浓硫酸与铁在加热条件下反应生成二氧化硫气体,稀硫酸与铁反应生成氢气,检验二氧化硫气体可用品红溶液,用A装置,然后在A装置中用高锰酸钾溶液(或NaOH溶液)除去二氧化硫气体,再在A中用高锰酸钾酸性溶液(或品红)检验二氧化硫是否除尽,在A或C装置中干燥(用浓硫酸(或碱石灰))后通入D中(氧化铜粉末)吸收氢气,然后在E中用无水硫酸铜固体检验是否有水生成,为防止空气中的水进入E中影响实验结果,应最后连接A或C,
故答案为:A-A-A(或C)-D-E-A(或C)或A-A-A-A(或C)-D-E-A(或C);
品红溶液--高锰酸钾酸性溶液-浓硫酸(或石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸碱石灰,
或:品红溶液-高锰酸钾酸性溶液-高锰酸钾酸性溶液(或品红)-浓硫酸(或碱石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸或碱石灰,或:品红溶液-氢氧化钠溶液-高猛酸钾酸性溶液(或品红)-浓硫酸(或碱石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸或碱石灰;
②若混合气体中含有氢气,D中固体粉末由黑色变为红色,生成铜和水,E中固体由白色变为蓝色,
故答案为:D中固体粉末由黑色变为红色,E中固体由白色变为蓝色;
(3)①测定混合气体中各成分含量,应知道气体的总量和某一种气体的量,氢气的量可根据反应前D中氧化铜粉末质量反应后D中粉末的质量计算,
故答案为:混合气体的总体积;反应前后D中粉末质量的差值(反应前D中氧化铜粉末质量反应后D中粉末的质量);
②检验Fe3+可用KSCN溶液,n(Fe)=
=0.2mol,11.2g 56g/mol
则n(Fe2+)+n(Fe3+)=0.2mol,由2Fe2++Cl2=2Fe3++2Cl-,可知n(Fe2+)=2n(Cl2)=2×
=0.1mol,1.12L 22.4L/mol
则n(Fe3+)=0.1mol,
故答案为:KSCN溶液;0.1.
