我国有较长的海岸线,海洋资源十分丰富.以下是对海水资源的部分利用.
(1)海水中含量最高的盐是______,海水经______结晶可获得粗盐.
工业上采用如下的流程从海水中提取精盐:
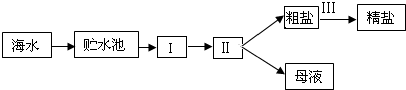
上述流程中Ⅰ、Ⅱ、Ⅲ分别是______、______、______.
(2)粗盐中含有泥沙、硫酸镁、氯化钙等杂质.将粗盐溶于水,然后再进行如下操作即可得到较纯的氯化钠:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液.正确的操作顺序是______.
(3)从“晒盐”后的母液(卤水)中提取重要金属镁.提取镁的步骤如下:
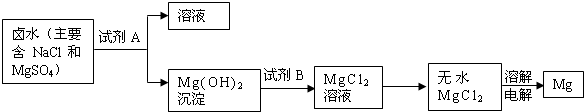
提取Mg的过程中,试剂A最好选用______,试剂B选用______.电解无水MgCl2的过程中______能转化为______能.
(1)海水中含量最多的物质是水,其次是氯化钠;
因为氯化钠的溶解度受温度影响不大,所以采用蒸发结晶的方法提取食盐;
工业上提取食盐的步骤为:海水进入贮水池,再依此进入蒸发池、结晶池,经过滤可得到母液和粗盐,粗盐进一步提纯为精盐.
故答案为:氯化钠、蒸发结晶、蒸发池、结晶池、提纯.
(2)粗盐溶于水后得到的溶液中含有MgSO4、CaCl2、NaCl,先向混合溶液中加入足量的NaOH溶液,此时得到的混合物为:Mg(OH)2沉淀、Na2SO4、Ca(OH)2沉淀、NaOH、NaCl,再向刚得到的混合中加入过量的BaCl2溶液,此时得到的混合物为:Mg(OH)2沉淀、BaSO4沉淀、Ca(OH)2沉淀、NaOH、NaCl、BaCl2,再向混合物中加入过量的
Na2CO3溶液,得到的混合物为:Mg(OH)2沉淀、BaSO4沉淀、CaCO3沉淀、NaOH、BaCO3沉淀、NaCl、
Na2CO3,此混合物经过滤后得到NaOH、NaCl的混合溶液,此时加入适量的盐酸,即可得到较纯净的氯化钠溶液,最后提取氯化钠即可.
故答案为:②⑤④①③
(3)因为海岸上有丰富的石灰石资源,锻烧石灰石可以得到氧化钙,而氧化钙溶于水可制得氢氧化钙溶液,所以A试剂应是氢氧化钙溶液,该实验流程如下:向NaCl、MgSO4的混合溶液中加入试剂A即Ca(OH)2后可得到Mg(OH)2沉淀,向Mg(OH)2沉淀中加入稀盐酸可得到MgCl2溶液,然后经蒸发、电解可得到Mg.
故选Ca(OH)2、稀盐酸、电能、化学能
